
투여 횟수가 제한됐던 신경내분비종양 치료제가 정부로부터 초과 사용 승인을 받았다. 해외원정치료를 나가야만 했던 환자들의 치료 접근성이 높아질 것으로 기대된다.
건강보험심사평가원은 지난 29일 제4차 암질환심의위원회를 열고 요양기관에서 신청한 방사성의약품 ‘루타테라’(성분명 루테튬 옥소도트레이오타이드)에 대한 사용을 일부 승인했다. 이번 승인을 통해 루타테라의 허가 범위 외 초과 사용이 가능해진다.
루타테라는 급여 4회, 비급여 2회로 투약 횟수가 제한돼 있다. 신경내분비종양 환자단체는 이로 인해 환자들이 독일, 말레이시아 등으로 해외 치료를 떠나야 한다며 올해 1월 국민 청원에 루타테라 투여 횟수 확대를 촉구하는 청원을 올리기도 했다.
이에 심평원은 ‘허가 또는 신고 범위 초과 약제 비급여 사용승인 제도’를 검토하고, 이번 암질심에서 루타테라에 대한 적용을 심의했다.
요양기관은 △다학제적위원회 심의 후 신청 △암질심 심의 △요양기관에 사용승인 결과 통보 △요양기관 사용내역 연 1회 제출 등의 절차를 거쳐 루타테라의 추가 치료를 이어갈 수 있다.
이날 암질심에서는 레코르다티 코리아가 내놓은 신약 ‘콰지바주’(성분명 디누툭시맙)의 급여기준도 설정됐다.
콰지바주는 허가·평가·협상 병행 시범사업 대상 1호 약제로 식품의약품안전처 허가와 급여 평가, 약가 협상이 동시에 진행된다.
암질심은 콰지바주가 만 12개월 이상 소아를 대상으로 할 때 △이전에 유도 화학요법 이후 부분반응 이상을 보인 후 골수 제거 요법과 줄기세포 이식을 받은 이력이 있는 고위험군 신경모세포종 △재발성 또는 불응성 신경모세포종 등에 효과가 있다고 평가했다.
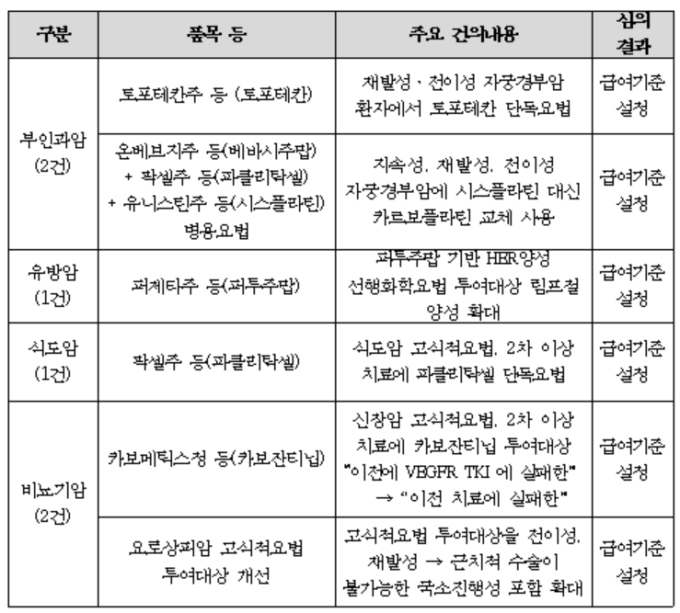
한편, 심평원은 지난해 12월 대한의사협회, 대한병원협회 등 각 의학회로부터 문제 제기가 된 항암제 급여기준에 대해 개선 의견을 수렴했다. 이번에는 부인과암과 유방암, 식도암, 비뇨기암 등 총 6개 항목에서 항암제 급여 심의가 이뤄졌다.
박선혜 기자 betough@kukinews.com

































