삼성바이오에피스와 셀트리온이 미국 바이오시밀러 시장에서 경쟁을 벌일 전망이다.
최근 삼성바이오에피스는 미국 식품의약국(FDA)로부터 ‘휴미라’의 바이오시밀러 ‘하드리마’ 고농도 제형에 대한 허가를 획득했다. 휴미라(성분명 아달리무맙)는 다국적 제약사 애브비의 자가면역질환 항체치료제다. 염증 반응에 영향을 주는 종양괴사인자의 발현을 억제하는 기전이다. 아달리무맙은 류마티스 관절염과 궤양성 대장염을 비롯해 강직성 척추염, 건선, 루프스 등의 치료에 사용된다.
삼성바이오에피스는 앞서 2019년 7월 하드리마 저농도(50mg/mL) 제형에 대한 FDA 허가를 획득하면서 미국 시장에 휴미라 바이오시밀러를 처음으로 선보였다. 이번 허가는 고농도(100mg/mL) 제형에 대해 성사됐다. 삼성바이오에피스는 오는 2023년 7월 이후 오가논을 통해 하드리마를 미국 시장에 출시할 계획이다.
하드리마는 고농도 제형의 시장 선점에 유리한 위치를 점했다. 이전까지 미국에서 아달리무맙 고농도 제형은 오리지널 의약품인 휴미라가 유일했다. 하드리마 고농도 제형이 FDA에서 허가한 유일한 바이오시밀러인 셈이다. 아달리무맙은 주사기로 투약한다. 고농도 제형은 투약량과 횟수를 줄일 수 있어 환자들의 투약 편의성이 높아, 처방 수요도 고농도 제형에 집중된다.
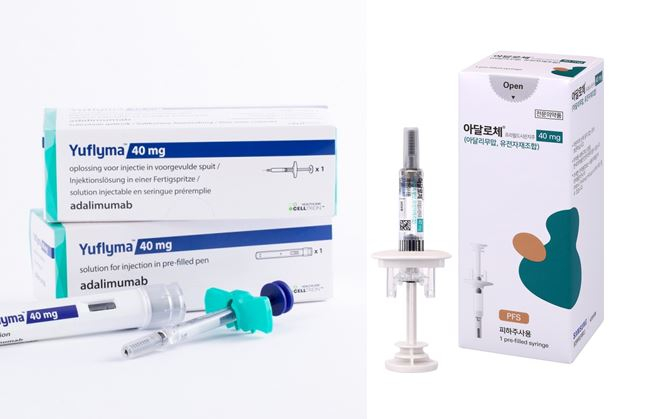
국내 기업 가운데 셀트리온이 삼성바이오에피스를 추격하고 있다. 셀트리온 역시 휴미라의 바이오시밀러 ‘유플라이마’를 고농도 제형으로 개발했다. 앞서 2020년 FDA 허가를 신청하고 결과를 중이다. 유플라이마는 이와 별개로 휴미라와 유플라이마의 상호교환성 인정을 위한 임상 3상을 FDA에 신청한 상태다. 미국에서 상호교환성이 인정된 의약품은 약사가 대체해 제공할 수 있다.
미국 시장은 삼성이 앞섰지만, 셀트리온은 유럽 시장에 먼저 진출했다. 유플라이마는 지난해 2월 40mg/0.4ml 용량에 대해 유럽의약품청(EMA)의 허가를 받았다. 이후 올해 2월 80mg/0.8ml 용량도 추가로 허가됐다. 휴미라 바이오시밀러 고농도 제형에 대한 EMA 허가는 유플라이마가 최초 사례다. 유플라이마는 류마티스 관절염, 염증성 장질환, 건선 등 휴미라의 적응증을 모두 동일하게 획득하고 출시된 상태다.
유럽과 국내 시장에서는 이미 두 회사의 경주가 한참이다. 하드리마 저농도 제형은 앞서 2018년 10월 유럽에서 제품명 ‘임랄디’로 출시됐다. 판매는 바이오젠과 손을 잡았다. 국내에서는 지난해 5월 건강보험 급여가 적용되면서 제품명 ‘아달로체’로 출시해 현재 유한양행을 통해 판매되고 있다. 유플라이마의 경우 지난해 2월 유럽 허가에 이어 10월 식품의약품안전처에서도 허가를 받았다. 올해 3월1일부터 건강보험 급여가 적용되면서 같은 그룹사인 셀트리온제약이 국내 판매를 본격화했다.
앞으로 휴미라 바이오시밀러 시장 경쟁은 더욱 치열해질 전망이다. 오리지널 의약품의 특허가 유럽에서 앞서 2016년 만료된 이래 국내외 대형 제약바이오 기업들이 앞다퉈 바이오시밀러를 내놨기 때문이다. 미국에서 휴미라의 특허가 만료되는 시점은 내년 1월이다. 삼성바이오에피스 이외에도 화이자, 암젠, 베링거인겔하임, 산도스 등 다수의 다국적 기업들이 휴미라 바이오시밀러에 대한 FDA 허가를 획득하고 출시를 대기하고 있다.
애브비의 사업보고서에 따르면 휴미라의 지난해 매출은 약 206억9400만달러(한화 27조원)로 집계됐다. 가장 큰 시장인 미국에서의 매출이 173억3000만달러(22조원)를 차지했다. 매출의 대부분은 고농도 제형에서 발생했다. 아이큐비아(IQVIA) 집계에 따르면 지난해 기준 미국에서 판매되는 휴미라의 80% 이상은 고농도 제형이다.
한성주 기자 castleowner@kukinews.com


































