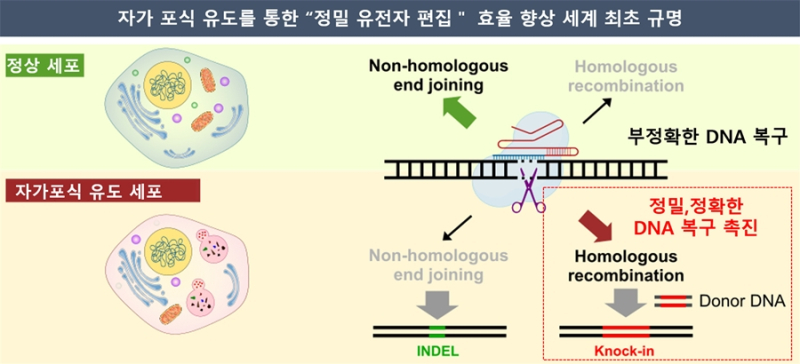
크리스퍼-캐스나인(CRISPR-Cas9) 유전자가위는 원하는 DNA 부위를 정밀하게 자를 수 있는 효소 ‘Cas9’을 이용해 유전자를 교정할 수 있는 혁신기술이다.
그러나 잘린 부위를 붙이는 DNA 복구과정이 부정확한 비상동 말단 연결(NHEJ) 방식으로 이뤄진다. NHEJ는 세포가 이중가닥이 끊어진 DNA를 참고용 설계도 없이 바로 이어 붙이는 ‘응급복구 방식으로, 대부분의 세포는 손상 DNA에 대해 NHEJ로 복구를 시도한다. 이 때 붙이는 과정에서 당초 있어야 할 일부 염기가 빠지거나 순서가 바뀌며 염기서열이 망가져 원래 유전자 기능이 망가질 수 있다.
반면 상동 재조합(HR)은 세포가 DNA 손상을 유사하거나 동일한 염기서열을 이용해 정밀 복원한다.
유전자편집 효율 3배 향상
한국화학연구원(이하 화학연) 남혜진 박사팀이 서울대 의대 조동현·배상수 교수팀과 공동연구로 영양결핍, 약물처리 등 다양한 자가포식을 유도하는 HR 기반 유전자 교정효율 향상기술을 개발했다.
자가 포식(Autophagy)은 세포 스스로 손상되거나 불필요한 단백질, 세포 소기관 등을 분해하고 재활용하는 생리적 작용으로, 세포가 산화 스트레스나 영양부족 상황에서 오염되거나 고장 난 구성요소를 제거해 노화지연, 암 억제, 에너지균형 등 다양한 생명현상을 조절한다.
연구팀은 세포가 손상된 성분을 제거·재활용하는 자가포식 과정이 HR 기반 유전자 교정 효율에 영향을 미칠 수 있다는 점에 주목했다.
굶주린 세포가 자가포식 과정 중 DNA 손상 복구에 영향을 미치는 단백질을 분비하는데, 이를 적절히 유도해 HR 효율을 높인 것이다.
연구팀은 세포에게 영양분이 없는 식염수만 주거나 성장신호 물질(mTOR) 억제제를 투입하는 방법으로 자가포식을 유도한 결과 DNA 손상 복구에 작용하는 다양한 보조인자들이 유전자가위 효소 ‘Cas9’ 주변에 모여드는 것을 관찰했다.
특히 DNA 손상 복구에 핵심인 RAD50, MRE11A, DNA2, TET2, ATRX 등 핵심 보조인자가 Cas9 단백질 주변에 더 많이 모였다.
이는 자가포식이 단순 분해작용이 아닌 HR 경로를 선택적으로 강화하는 분자 메커니즘을 통해 작동한 것임을 의미한다.
아울러 기존 유전자가위의 변형 버전인 ‘nickase Cas9(nCas9)’이나 불활성Cas9(dCas9)도 동일한 자가포식 유도 효과가 관찰돼 이번 기술이 다양한 유전자편집 플랫폼에 적용될 수 있음을 확인했다.
실제 자가포식을 유도한 세포에서는 HR 편집 효율이 1.4~3.1배 높아졌고, 삽입할 DNA 크기나 타깃 유전자 발현 수준에 상관없이 일관된 성능 향상이 나타났다.
반대로 자가포식 결핍 세포에서는 징밀 유전자 편집 효율이 높아지지 않았다. 이는 세포가 HR 방식으로 DNA를 정확하게 복구할 때 자가포식 기능이 필수임을 나타낸다.
실제 질병모델 실험에서 청각장애 유발 유전자 MPZL2 변이를 보유한 환자 유래 세포에 적용한 결과 정상 유전자가 도입된 RNA의 발현량이 증가했다.
연구팀은 이번 기술이 세포 수준을 넘어서도 유효한지 검증하기 위해 생쥐의 망막색소 상피조직에 생체실험을 진행했다.
Cas9 유전자 가위와 형광 단백질 유전자를 담은 DNA를 생쥐의 망막 아래층에주입하고, 동시에자가포식 유도제인 mTOR 억제제를 안구에 투여한 결과 유전자 교정이 성공적으로 진행했다.
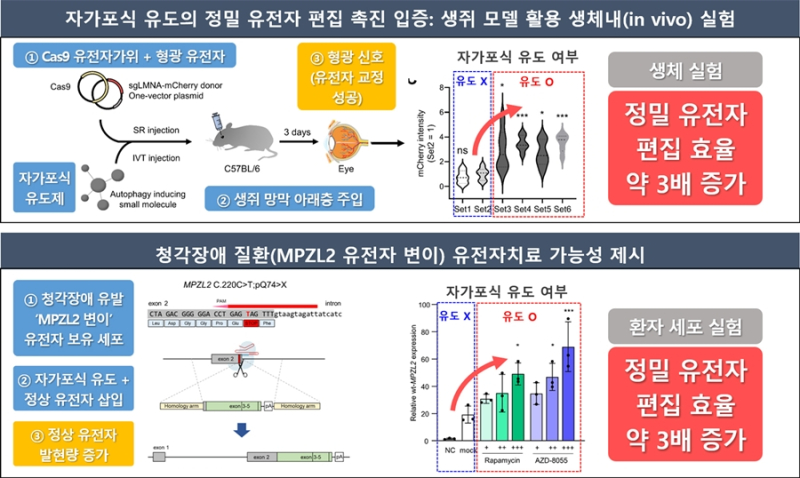
이는 자가포식 유도가 생체 환경에서도 HR 기반 정밀 유전자 편집을 촉진한다는 사실이 처음으로 입증힌 것이다.
연구팀은 이번 기술이 다양한 질환의 유전자 교정에 적용할 수 있는 보편적 접근법이 될 수 있도록 고도화할 계획이다.
이영국 화학연 원장은 “이번 연구는 정밀치료에 필수적인 유전자편집 기술의 안정성과 효율을 동시에 확보한 성과”라며 “향후 희귀유전질환 치료에 널리 활용되기를 기대한다”고 밝혔다.
한편, 이번 연구결과는 지난달 국제학술지 ‘핵산연구(Nucleic Acids Research(IF: 16.7))’에 게재됐다.






























